业务领域
同 心 关 爱 你 我 共 享
BUSINESS
太阳成tyc122cc集团有限公司-吲达帕胺滴丸临床研究报告
符合国家GMP标准要求的中西药制剂生产车间、中药提取车间、药物研究院、天然植物化妆品生产基地、化妆品科学技术研究院等,配套设施齐全,可以充分满足现代化、规模化、专业化、标准化生产的要求。
关键词:
太阳成tyc122cc集团有限公司-吲达帕胺滴丸临床研究报告
所属分类:
文献资料
产品附件:

咨询热线:
太阳成tyc122cc集团有限公司-吲达帕胺滴丸临床研究报告
图文详情
太阳集团吲达帕胺滴丸生物利用度试验:
依照国家药品管理法规定,吲达帕胺滴丸属化药5类新药,需进行人体生物利用度试验并与一种符合阳性标准的对照药进行生物等效性评价,旨在为临床安全、有效用药提供实验依据。试验工作是由上海中山医院国家药理临床试验基地,严格按照GCP规范进行设计并完成的。
该研究依据文献建立了测定人全血中吲达帕胺的高效液相色谱检测方法,这一方法在5-1000ng/ml浓度范围内线性关系良好(r=0.9999,n=8),高、中、低三种浓度的天内、天间RSD均小于7%;提取回收率均大于80%,方法回收率在94%-103%之间。全血中吲达帕胺的最低检测浓度为2.5ng/ml,适合于生物样品的分析要求。
试验药物:
•试验制剂:吲达帕胺滴丸(2.5mg/粒)
•参比制剂:钠催离片(2.5mg/片)法国施维雅药厂生产。
符合GCP临床试验对照药选择的要求,即公认、有效、已获准上市、已获准我国审批进口等。
受试者:
受试者按中国药典2000年版关于药物制剂人体生物利用度和生物等效性指导原则进行的筛选,均为男性,20名,年龄、身高、体重均符合要求,经询问病史,血、尿常规,肝肾功能,心电图等检查证实的健康受试者。
给药方案:
•将20名受试者随机分为两组,按表一设计采用自身对照交叉给药方式,单剂量口服试验制剂与参比制剂7.5mg。
表一:交叉给药方案
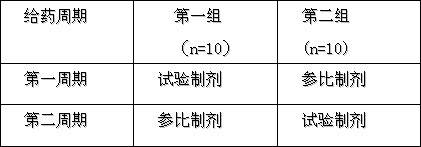
第一周期和第二周期两次给药间隔8天,以清除治疗残余效应。
血样采集:
•服药前取空白血,并分别在给药后0.5,1,1.5,2,3、5、8、12、24、36、48、60小时共12个时间点取静脉血做血样分析,采用高效液相-紫外检测方法测定全血血药浓度。
图3 :受试者口服试验制剂和参比制剂血药
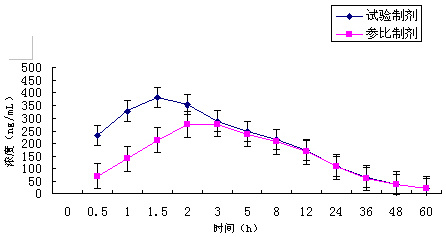
浓度平均值—时间曲线
数据处理:
•受试者口服吲哒帕胺滴丸,用梯形法计算AUC,Tmax和Cmax以实测值计算,采用统计矩方法计算其它药动学参数,主要药动学参数见表四。
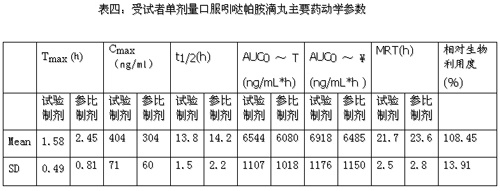
表四:受试者单剂量口服吲哒帕胺滴丸主要药动学参数
用3p97软件将Tmax、T1/2、Cmax、AUC0-T、AUC0-∞ 、MRT的值进行对数转换后再进行方差分析;Cmax、AUC0-T、AUC0-∞ 的值再用双单侧t检验进行生物等效性的判定,计算90%的置信区间,以证明试验制剂与参比制剂是否生物等效。
试验结果:
根据方差分析结果表明:试验制剂的Cmax和Tmax与参比制剂相比,均有显著性差异,试验制剂的Cmax和Tmax分别为404.13±70.79 ng/mL和1.58±0.49 h,参比制剂分别为304.02±59.51 ng/mL和 2.45±0.81 h。这说明试验制剂服用后吸收快,可迅速起效。试验制剂的MRT,T1/2与参比制剂相比无显著性差异。
经临床观察口服吲达帕胺滴丸7.5mg后受试者血压和心率比基础值稍有降低,但未见直立性低血压等不良反应。
根据置信区间法检验的结果表明:试验制剂的AUC0-T、Cmax与参比制剂相比,均无显著性差异。试验制剂AUC的90%可信限落在参比制剂101.5%--111.9%的范围内;Cmax落在125.7%--140.9%的范围内,故试验制剂与参比制剂生物等效(中国药典2000版二部附录P196)。试验制剂平均相对生物利用度为108.45±13.91%(n=20,以AUC0-T计算)。
[不良反映]
经临床观察口服吲达帕胺滴丸7.5mg后受试者血压和心率比基础值稍有降低,但未见直立性低血压等不良反应。
此外,研究报告附有对成品的检验报告,所包括性状、鉴别、检查有关物质、含量均匀度、溶散时限、微生物限度、含量测定等各项均符合国家标准规定。由于滴丸制剂在生产工艺,药物稳定性、均匀性、安全性,利于吸收等方面具有一定的优势,且有较好的性价比,为高血压病人的治疗提供了一种比较理想的新药。
上一页
糖尿病患者需慎选降压药
下一页
上一页
下一页
咨询




